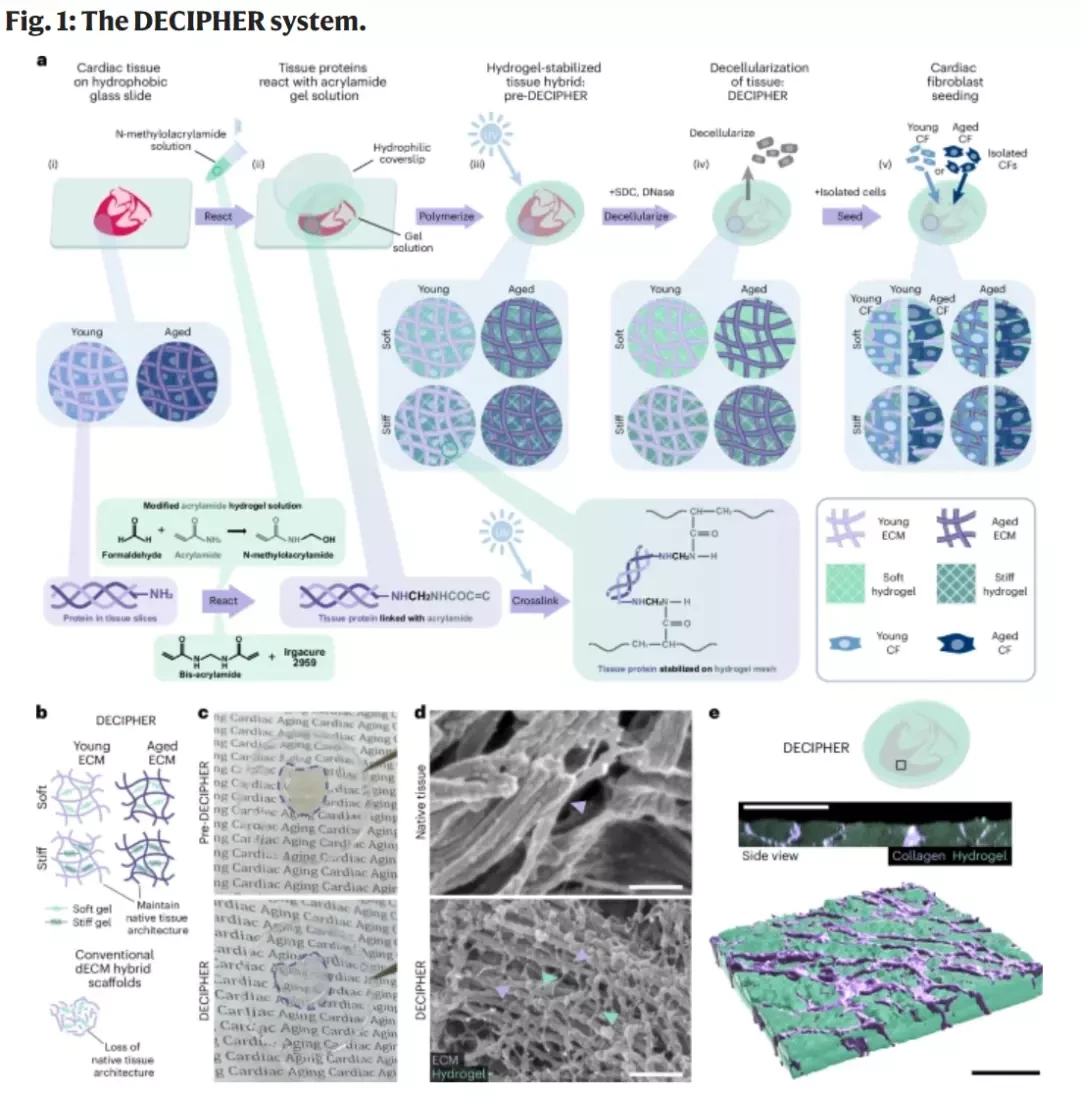
新加坡國立大學(NUS)團隊研發出一種名為DECIPHER的生物材料。研究發現,心臟衰老時,細胞外基質的「生化環境」比「物理硬度」對細胞影響更大。通過模擬年輕的生化信號,衰老的心臟細胞功能得以恢復,這為心臟抗衰老治療開闢了新途徑。

來源:NUS
新加坡國立大學(NUS)作為全球頂尖研究型大學,在生物醫學工程與衰老研究等領域屢獲突破,近日,在新加坡國家研究基金會(NRF)及衛生部醫學研究基金(MRC)的支持下,NUS團隊再次在心臟衰老研究上取得重大進展。

來源:Nature Materials
他們開發的新型生物材料證實,通過重塑心臟細胞的細胞外環境,可以逆轉因衰老導致的心臟功能衰退。這一發現為治療與年齡相關的心臟疾病開闢了全新的道路,相關論文已發表在《Nature Materials》上。
以往研究衰老時,人們大多關注細胞內部的變化。
但這次,新加坡國立大學(NUS)的團隊把目光投向了細胞外基質(ECM),也就是包裹著心臟細胞的蛋白質支架。
研究發現,心臟變老時,ECM不僅在物理上變硬,其化學成分也會改變,這兩者共同作用,導致細胞功能出問題,引發心肌纖維化、失去彈性等衰老表現。
領導這項研究的生物醫學工程系助理教授珍妮弗·楊及其團隊,開發了一種叫DECIPHER的新平台。這種材料能精確模仿年輕ECM的硬度和生化信號。

來源:NUS
通過實驗,衰老的心臟細胞竟然「返老還童」了——即使組織硬度沒變,細胞的基因表達和功能也恢復到了年輕時的水平。
在心臟衰老的研究中,細胞外基質(ECM)的物理硬度和生化信號變化一直是並行的,使得區分兩者影響變得困難。
NUS博士生孫瑞(Avery Rui Sun)作為研究第一作者,介紹了他們如何利用DECIPHER平台首次實現了對這兩者的獨立控制。
來源:Nature Materials
他們的研究發現了一個關鍵區別:
對於已經衰老的心臟細胞,生化信號的變化起著主導作用,比物理硬度的影響大得多;而年輕細胞則同時受到物理硬度和生化信號的共同調控。
實驗數據清晰地展示了這一點:
衰老細胞在「年輕生化信號」的刺激下,大量衰老相關基因的活性得以恢復;而年輕細胞一旦處於「衰老生化信號」環境中,其功能便會提前衰退。
這一發現從根本上改變了我們對心臟衰老機制的理解,強調了細胞外環境的生化信號重塑可能是逆轉衰老過程的關鍵所在。
儘管目前研究尚處基礎階段,該團隊認為,這項成果為心臟健康干預帶來了革命性的新思路:未來或許能通過調控細胞外基質(ECM)的生化信號,開發出無需依賴細胞移植的心臟年輕化療法。

來源:NUS
珍妮弗·楊助理教授強調,即使在僵硬的衰老心臟組織中,恢復年輕ECM的生化信號也能促進細胞功能修復,這意味著「重置環境」而非「替換細胞」可能成為改善心臟衰老的新途徑。
該技術的應用前景廣闊,由於ECM在多種器官衰老及疾病(如腎臟纖維化、皮膚老化、癌症等)中作用關鍵,DECIPHER平台有望拓展至多組織研究,為防治年齡相關疾病提供通用策略。
這項由NUS多個院系及研究中心專家聯合完成的研究,得到了NUS科研副校長的肯定,他期待加速技術向臨床應用的轉化。
來源:學校官網