作者:王康威,陳勁禾
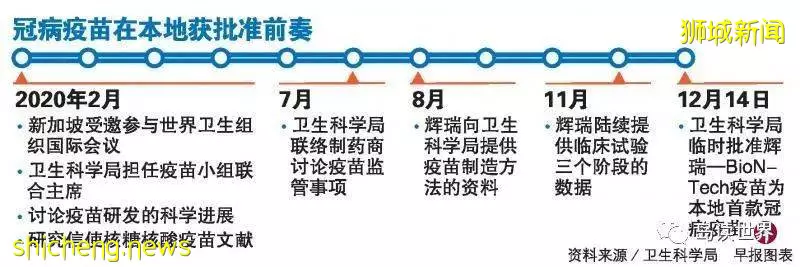
輝瑞(Pfizer)—BioNTech和莫德納(Moderna)兩款冠病疫苗,分別在去年12月14日和今年2月3日獲衛生科學局的臨時批准,科興生物的審批工作,目前還在進行中。
負責評估疫苗的衛生科學局醫療保健產品管理司司長曾清靈副教授接受《聯合早報》的專訪時,介紹和說明了疫苗的批准過程,並向公眾強調他們如何確保疫苗的安全。
冠病疫苗必須經過衛生科學局設下的層層評估關卡和三輪專家評估,滿足了重重嚴格的要求,才被獲准供本地使用接種。
曾清靈副教授強調,雖然疫苗的研發和評估的時間比其他疫苗來得快,但作為允許疫苗在新加坡上架的「終審機構」,衛生科學局不但沒有抄捷徑,反而在短時間內,為各款冠病疫苗設下更多通關考驗,以期達到安全至上的目的。

衛生科學局醫療保健產品管理司司長曾清靈副教授指出,雖然冠病疫苗的研發和評估的時間比其他疫苗快,但衛生科學局沒有抄捷徑,而是在短時間內為各款疫苗設下更多通關考驗,以確保安全,希望新加坡人都能放心接種。(陳來福攝)
她透露,衛生科學局的工作早在去年7月就已經開始。當我國政府同輝瑞、莫德納,以及科興生物簽訂冠病疫苗的預購協議後,該局便主動同這三家藥劑公司聯繫,要求他們提交數據。當時,團隊主要收集的是關於疫苗技術的最新信息,三家公司在研發和測試的同時,也須陸續提交滾動式數據,衛生科學局一收到數據便會立刻評估。
輝瑞疫苗去年底運抵我國,目前已開始在年長者中施打。(林澤銳攝)
今年56歲的曾清靈是在1997年加入衛生科學局,並在2001年起成立衛生科學局的藥物警戒(Pharmacovigilance)團隊。她從2011年起陸續擔任醫療保健產品管理司助理司長和副司長,在2017年接任司長一職。她今年3月中會接種冠病疫苗。
曾清靈介紹,衛生科學局每年平均審批300多款藥物。為了應付這樣的工作量,他們有65名評估員,評估一款疫苗通常由六人專門負責。
這六個人再分工,專門分析疫苗研發的每一個步驟,另外,專攻動物毒理學和良好生產規範的專家也為他們提供協助。
六道嚴格評估關卡
衛生科學局根據疫苗研發的各個階段,設下六道嚴格評估關卡。首先是檢查疫苗的化學配方(chemical formulation),看看是否存有雜質;第二道關卡是評估疫苗在動物的測試。設定這兩個關卡,主要是為了確保不同劑量疫苗的化學成分,以及在動物身上的測試,是否達到符合安全的標準,才能進入臨床測試。
接下來必須跨過的三道關卡,則是疫苗的三期臨床測試。
第一期是對約300名對象進行不同劑量的測試,確保疫苗的安全性。
第二期臨床測試是研究疫苗的治療效果。
第三期測試,則是讓大規模對象進行疫苗和安慰劑的對照試驗,以測試藥物的治療效果,以及是否比那些只注射安慰劑的人,產生了更多的不良反應。
通過了這五道關卡後,生產商也須滿足第六項要求:證明有良好生產規範(Good Manufacturing Practice,簡稱GMP),能安全且大規模地生產疫苗,才能獲得批准。
比其他疫苗臨床測試更容易找到染病者
曾清靈也指出,疫苗的研發程序和其他疫苗相似,但不同之處是,有鑒於流行病肆虐,進行臨床測試時反而容易找到染病的人,以研究了解注射了疫苗的群體中的染病人數比注射了安慰劑的群體少了多少,從而證明疫苗的效用。
她說:「我們沒有抄捷徑,輝瑞對4萬人進行了測試,莫德納超過3萬人,一般上,獲批准疫苗如水痘疫苗的臨床測試人數也大約是3萬人。」
疫苗完成評估後,還須進行三輪的專家審查,通關要求比一般疫苗和藥物來得更為嚴謹。
通過新加坡保健服務集團副總裁馮國榮教授領導的衛生科學局11人藥物諮詢委員會的審查後,衛生科學局接著安排國家傳染病中心主任梁玉心教授在內的四名傳染病專家進行評估,之後還須通過衛生部14人冠病疫苗專家團的鑑定。
曾清靈說:「我們的工作,讓新加坡成為首個引進冠病疫苗的亞洲國家之一,讓大家能提早接種。我們對疫苗做了很嚴謹、全面、透徹的評估,對於能在這個過程做出貢獻,我們感到很榮幸,希望大家也對我們的工作有信心。」
要獲批正式使用 須提交長期數據
冠病疫苗製造商要在本地獲得正式使用批准,須提交包括疫苗耐用性在內的長期數據,曾清靈副教授估計這需要一年時間。
針對有公眾擔心接種疫苗多年後會出現副作用,她受訪時說,當局批准任何疫苗通常會要求一兩年的數據。
「你只能在合理的時間內收集某些數據,不能永無止境。當然,大家都想等個20年,但那時候疫情可能已經結束。」
按照大流行病特別採用程序,冠病疫苗獲得的是臨時批准,當局可以隨時撤銷,比如在發現數據顯示好處不足以彌補風險的時候。
臨時批准意味疫苗分配受到政府控制
曾清靈說,臨時批准意味著疫苗的分配受到政府控制,當製藥商獲得正式批准,它們就有行銷疫苗的自由。
要獲得正式批准,藥商須提交有關數據,證明疫苗的保護作用持久,以及接種疫苗者的安全是長期的。
此外,他們須證明製藥廠能大規模生產品質一致的疫苗。雖然廠商目前生產的疫苗數量已相當可觀,但曾清靈說,疫苗商業化之後,生產數量會更高。
獲批不代表得到「免死金牌」
獲得正式批准的藥物並非就佩戴「免死金牌」。例如原獲准作肥胖症輔助藥物的西布曲明(sibutramine),後來發現造成心血管疾病風險提升,已在2010年禁用。
曾清靈說,按每10萬名居民出現不良反應的發生率來看,新加坡是獲世界衛生組織認可為不良反應通報率排名第一的國家。
「如果有任何一群人出現異常的嚴重不良反應,我們都會知道。病患會知道監管當局在密切留意。」
「足不出戶」遠程把關
疫情期間無法出國考察,衛生科學局如何確保國外的疫苗廠商遵守良好生產規範?
原來,即便沒有疫情,衛生科學局也可以「足不出戶」就能遠程把關。
曾清靈解釋,新加坡是國際藥品認證合作組織(Pharmaceutical Inspection Co-operation Scheme,簡稱PIC/S)的會員國,這52個會員國的藥物監管機構採取了通用的標準,檢查藥廠的生產設施,共享報告,因此各國的衛生科學家不出國也能進行評估。
新加坡自2001年已是成員國之一,也是該組織的第一個亞洲國家。
曾清靈說:「例如,在本地生產的疫苗和抗生素,衛生科學局會在本地檢查,確保工廠符合國際標準,並向其他國家共享報告。如果我們發現問題,也可以向評估這個藥的外地監管單位詢問,這是疫情暴發前就已制定的程序。」
疫情期間,衛生科學局也緊密地和外國的監管單位合作並交換情報。其中,新加坡和加拿大、瑞士、澳大利亞和英國的同行組成「ACCESS」集團,每兩周會定期溝通和交換情報。
其中,英國作為全球首個進行疫苗接種的國家,也向包括新加坡在內的國家傳授寶貴經驗,接種後觀察30分鐘的標準,就是我國向他們借鑑而來的。
疫苗效能並非獲批唯一考量
哪類疫苗會獲得批准?衛生科學局指出,疫苗的效能(efficacy)並非唯一考量,即便效能較低,但在物流運輸方面能更順暢,適合接種的人群更廣,衛生科學局也會考慮採用。
針對衛生科學局批准疫苗的條件有哪些,曾清靈一再強調安全、有效,以及高品質三個標準。其中關於疫苗的安全性,指的不僅僅是人們注射疫苗後是否出現不良反應。
曾清靈說:「當我們說安全性,必須從疫苗的化學配方以及在進行動物測試時就必須把關,確保疫苗沒有不良的雜質、在動物上的測試也不會出現不良反應。我們也必須了解受測試的動物有沒有遭受虐待,或是出現不良反應。到了人類測試的階段,我們必須確保疫苗不會對人類造成異常的不良反應,副作用和死亡率也不會高於基準線。」
輝瑞4萬4000名測試者中出現了六起死亡,但是當中兩人注射了疫苗,四人注射了安慰劑。莫德納的3萬名測試者中則有13人死亡,其中六人注射疫苗,七人注射了安慰劑,注射疫苗群體的死亡率並沒有高於注射安慰劑的群體,顯示疫苗是安全的。
採用信使核糖核酸(mRNA)技術的輝瑞和莫德納都有近95%的效能,曾清靈說,兩款疫苗設下高標準,但並非所有疫苗都須達到這樣的標準。
例如無須超低溫冷藏或適用於孕婦和免疫功能低下病患的疫苗,可以彌補目前兩款疫苗的不足之處,在評估時必須考慮在內。如果大多數人都能接種,無需高效能的疫苗就達到群體免疫。
其他疫苗生產商也同我國接洽
目前,衛生科學局已收到中國冠病疫苗廠商科興生物的初始數據,並已開始評估。曾清靈透露,除了科興生物,也有一些疫苗生產商正與衛生科學局接洽,但細節不便透露。
根據科興生物本月初發表在《柳葉刀》的第三階段臨床測試顯示,疫苗效能介於50.65%至100%。曾清靈說,由於還未收到科興提供的完整數據,目前不便進一步評價。
「他們使用的滅活病毒疫苗是一般人比較熟悉的科技,但這類疫苗有如流感疫苗一樣,效能一般不會高於90%。」
mRNA和滅活病毒技術孰優孰劣?杜克—新加坡國立大學醫學院新發傳染病重點研究項目副主任黃英勇教授之前受訪時曾這麼比喻:「疫苗是讓我們的免疫系統通過不同方式認識病毒,例如看照片或是視頻。滅活病毒技術比較像是圖像,只能看到病毒的表面,mRNA比較像是視頻,讓免疫系統能看到病毒刺突蛋白的方方面面。」

針對科興疫苗雖然還未獲得批准就已經抵達新加坡,曾清靈說,不同國家有不同的政策,一些歐美國家的藥商一般會等到藥物獲得接收國批准後才開放出口。
衛生科學局團隊視安全至上
衛生科學局團隊成員為了加速審查疫苗數據而須加班,曾清靈多年來負責本地藥物的安全監管,她說:「對安全的重視,已經在我的DNA里。」
即使在評估冠病疫苗的同時,醫療保健產品管理司也必須履行原有的責任,對其他要進入新加坡市場的藥物和醫療器材進行評估,因此須加倍努力地完成工作。
出於對疫苗的重視,衛生科學局也特別安排了最具有經驗的評估員進行這份工作,讓他們能憑藉經驗,做出最全面的評估。
曾清靈說:「這份工作需要他們投入很長的時間,開始評估疫苗時,我們的評估員往往必須加班,從早上8時半一直工作到超過晚上10時。到了審批的最後階段,由於必須完成報告,他們有時候甚至需要工作到凌晨一兩點。不過我們一定會確保評估是透徹的,而這也是我們竭盡所能幫助國家對抗冠病疫情。」
曾清靈也謙虛地表示,工作雖辛苦,但想到前線醫護人員必須日以繼夜冒著生命危險對抗病毒,也推動著他們做出貢獻。
她說,自己一向重視對藥物監管的警戒,對冠病疫苗也是如此,比如,衛生科學局會記錄每名接種者的疫苗種類和批號,萬一發生事故,可以馬上知道是哪批疫苗出了問題。
























