新加坡是东南亚唯一的发达国家,也是亚洲人均GDP最高的国家。
不仅如此,新加坡也是亚洲的医疗中心,提供了亚洲最好的医疗保健系统,吸引着邻近的马来西亚、文莱、印度尼西亚、泰国、菲律宾以及来自美洲、欧洲和亚太地区的患者进行治疗。
因此,医疗器械类产品也成为了新加坡进口的一大热门。那么,医疗器械类产品如何进入到新加坡市场呢?别着急,今天,小卓就为大家一一讲解“新加坡医疗器械”进口的那些事儿!
1 新加坡卫生科学局 HSA
在新加坡,医疗器械的监管机构是新加坡卫生科学局(Health Sciences Authority, HSA)。HSA 成立于2001年4月,隶属于新加坡卫生部(Ministry of Health (MOH) Singapore) ,是负责监管西药、医疗器械、辅助健康产品、化妆品等产品的新加坡法定机构。
在制定医疗器械的监管框架时,HSA参考了发达国家的医疗器械监管系统,包括美国食品和药物管理局(FDA) 、欧盟公告机构(EU NB)、加拿大医疗器械局(MDB)、日本卫生劳动福利部(MHLW)和澳大利亚治疗用品管理(TGA)等机构,并结合自身情况,摸索出一套适应新加坡情况的医疗器械监管体系。
新加坡针对医疗器械的管理法规主要为《Health Products Act 2007》,《 Health Products (Medical Devices) Regulations 2010》等。另外作为东盟ASEAN成员国,新加坡也会参考东盟的相关法规,ASEAN Medical Devices Directive (AMDD) 东南亚国家医疗器械指令。
想了解更多关于医疗器械监管要求和指南的信息,可以参阅HSA“Medical devices”医疗器械的网站页面,点击官网链接如下:
https://www.hsa.gov.sg/medical-devices/
2 产品定义
在新加坡,“医疗器械”是指单独或组合使用,用于人类如下一个或多个特定目的的任何仪器、器材、机器、器具、植入物、体外试剂、校准器、软件、材料或其他类似的物品:
1 诊断、预防、监测、治疗或减轻任何疾病。
2 损伤的诊断、监测、治疗、缓解或赔偿。
3 解剂或生理过程的研究、替代、调节或支持。
4 支持或维持生命。
5 妊娠控制。
6 医疗器械的消毒。
7 通过对取自人体的样本进行体外检查的方式来提供医疗信息。
3 产品分类
在新加坡,体外诊断产品(IVD)视为医疗器械产品(MD)的子集。新加坡医疗器械的分类规则以全球医疗器械协调工作组(GHTF)建议为基础。
所有医疗器械在新加坡供应之前都需要向HSA注册 ,但 A 类非无菌低风险医疗器械除外,它们免于产品注册,或在HSA批准的特定条件下提供。
医疗器械的风险分类取决于产品的设计和预期用途。新加坡将医疗器械(包括IVD)根据风险由低至高分为A、B、C、D四类。A类风险最低,D类风险最高。
具体分类如下:
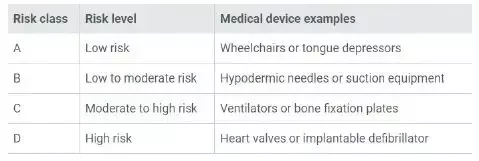
1 新加坡常规医疗器械分类
A 低风险
手术牵引器、压舌板。
B低-中度风险
皮下注射针、吸入式设备
C 中-高度风险
肺呼吸机、骨固定板
D 高风险
心脏瓣膜、植入式初颤器
英文原文见下图:
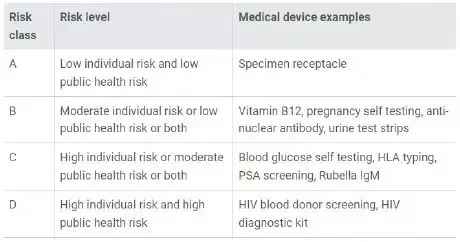
2 新加坡体外诊断医疗器械分类
A 低个人风险和低公共健康风险
试样贮器
B 中等个人风险和低等公众健康风险
维生素B12,妊娠自我检测,抗核抗体,尿液试纸
C 高个人风险和中等公众健康风险
血糖自我检测,HLA分型,PSA筛查,风疹lgM
D 高个人风险和高公众健康风险
艾滋病毒献血者筛查,艾滋病毒诊断试剂盒
英文原文见下图:
4 产品注册
新加坡实行与国际接轨的医疗器械分类管理制度,即按安全风险将医疗器械分为A、B、C、D类共4个类别进行管理。
根据新加坡《健康产品法令》及《健康产品(医疗器械)条例》的规定,除了豁免产品,所有类别的医疗器械产品都必须经过HSA注册方可在新加坡上市销售。
新加坡当地没有营业地点的境外制造商需指定一名符合要求的注册登记人。注册登记人必须在HSA注册登记拥有相应的经销商许可证(Dealer’s Licence),一系列的申请工作将由注册登记人进行。
注册人或申请人须通过HSA的医疗器械信息与通讯系统Medical Device Information and Communication System在线提交申请。凡是经过注册的医疗器械,都列入新加坡医疗器械注册清单(SMDR) 中,消费者可在线查询所购买的医疗器械是否经过注册。
A类医疗器械的注册申请分为4步,即提交申请、筛选、评审、主管部门作出决定。其中,非无菌A类医疗器械可以免除注册,但该类医疗器械仍需符合医疗器械安全与性能的基本要求,不得与相关法律法规相抵触。无菌A类医疗器械(含体外诊断器械)仍需进行注册。
BCD类产品的申请材料包括,参照东盟通用提交资料模板(CSDT)准备的英文申请,相关证书、报告和标签复印件。同时,还应提交良好的流通规范证书(GDPMDS)或医疗器械质量管理体系ISO 13485证书。如果已经获得美国(美国食品和药物管理局)、欧洲(欧盟公告机构)、澳大利亚(澳大利亚治疗用品管理局)、日本(日本厚生劳动省)、加拿大(加拿大卫生部)上市批准,在提供相关证明文件后,可加快注册甚至立即注册。
此外,申请公司还需要指定一名主要联系人,负责与主管部门联络与申请相关的所有问题,包括按要求补充材料等。提交注册文件,并且当局批准后,会列入SMDR(Singapore Medical Device Register)数据库,申请人应遵守所有的注册后条款。并对后续活动负责。

5 申请流程
在确定了医疗器械的评估路线和风险等级后,根据不同的类别分类,可以在官方查看详细的相关指南,了解完成注册所需的文件、费用和处理时间。
Class A
不需要进行注册。在申请经销商许可证时需要列明相应的豁免Class A类产品信息。
Class B
Full route
产品如果没有被任何一个海外参考监管机构批准,则必须选择该途径,由HSA对产品进行全面评估。
Abridged route
产品目前已被至少一个海外参考监管机构批准,就可选择该简略的评估途径注册。
Immediate route
符合以下条件就有资格选择该途径进行申请,条件一:
1. 至少一个海外参考监管机构批准。
2. 在其中一个海外参考监管机构的管辖范围内至少销售了三年。
3.没有因质量、性能或安全问题而被任何一个海外参考监管机构拒绝/撤回。
4.在过去3年或产品自在全球上市以来,全球范围内没有与使用该医疗器械有关的安全问题。
条件二:
1. 至少两个海外参考监管机构批准。
2.没有因质量、性能或安全问题而被任何海外参考监管机构拒绝/撤回。
3.在过去三年中,全球范围内没有与使用该医疗器械有关的安全问题。

Class C
Full route
如果没有被任何一个海外参考监管机构批准,则必须选择该途径,由HSA对产品进行全面评估。
Abridged route
产品目前已被至少一个海外参考监管机构批准,就可选择该简略的评估途径注册。
Expedited route
快速评估途径有两种,产品只要符合其中一种快速评估途径的要求即可提交申请。
加快评估途径一
1. 至少被一个海外参考监管机构批准。
2. 在被批准的海外参考监管机构的管辖范围内至少销售了三年时间。
3. 在过去三年中,全球范围内没有与该医疗设备的使用相关的安全问题。
加快评估途径二
已获得至少两个海外参考监管机构的批准,就可通过该途径进行注册。

Immediate route
该途径仅适用于独立的医疗移动应用,需满足以下的要求:
1. 它仅仅是一个独立的医疗移动应用。
2. 至少获得一个海外参考监管机构的批准:
3. 没有因质量、性能或安全问题而被任何海外参考监管机构拒绝/撤回。
4. 在过去三年中,全球范围内没有与使用该医疗设备有关的安全问题

Class D
Full route
产品如果没有被任何一个海外参考监管机构批准,则必须选择该途径,由HSA对产品进行全面评估。
Abridged route
产品目前已被至少一个海外参考监管机构批准,就可选择该简略的评估途径注册。
Expedited route
医疗器械产品已获得至少两个海外参考监管机构的批准,则可选择该途径进行申请。
但对以下两类IVD产品的注册,该途径不适用 : HIV检测(筛查和诊断)

怎么样!是不是很详细呢~关于新加坡卫生科学局Health Sciences Authority的医疗器械管理,你都了解了吗?






