新加坡是東南亞唯一的已開發國家,也是亞洲人均GDP最高的國家。
不僅如此,新加坡也是亞洲的醫療中心,提供了亞洲最好的醫療保健系統,吸引著鄰近的馬來西亞、汶萊、印度尼西亞、泰國、菲律賓以及來自美洲、歐洲和亞太地區的患者進行治療。
因此,醫療器械類產品也成為了新加坡進口的一大熱門。那麼,醫療器械類產品如何進入到新加坡市場呢?別著急,今天,小卓就為大家一一講解「新加坡醫療器械」進口的那些事兒!
1 新加坡衛生科學局 HSA
在新加坡,醫療器械的監管機構是新加坡衛生科學局(Health Sciences Authority, HSA)。HSA 成立於2001年4月,隸屬於新加坡衛生部(Ministry of Health (MOH) Singapore) ,是負責監管西藥、醫療器械、輔助健康產品、化妝品等產品的新加坡法定機構。
在制定醫療器械的監管框架時,HSA參考了已開發國家的醫療器械監管系統,包括美國食品和藥物管理局(FDA) 、歐盟公告機構(EU NB)、加拿大醫療器械局(MDB)、日本衛生勞動福利部(MHLW)和澳大利亞治療用品管理(TGA)等機構,並結合自身情況,摸索出一套適應新加坡情況的醫療器械監管體系。
新加坡針對醫療器械的管理法規主要為《Health Products Act 2007》,《 Health Products (Medical Devices) Regulations 2010》等。另外作為東協ASEAN成員國,新加坡也會參考東協的相關法規,ASEAN Medical Devices Directive (AMDD) 東南亞國家醫療器械指令。
想了解更多關於醫療器械監管要求和指南的信息,可以參閱HSA「Medical devices」醫療器械的網站頁面,點擊官網連結如下:
https://www.hsa.gov.sg/medical-devices/
2 產品定義
在新加坡,「醫療器械」是指單獨或組合使用,用於人類如下一個或多個特定目的的任何儀器、器材、機器、器具、植入物、體外試劑、校準器、軟體、材料或其他類似的物品:
1 診斷、預防、監測、治療或減輕任何疾病。
2 損傷的診斷、監測、治療、緩解或賠償。
3 解劑或生理過程的研究、替代、調節或支持。
4 支持或維持生命。
5 妊娠控制。
6 醫療器械的消毒。
7 通過對取自人體的樣本進行體外檢查的方式來提供醫療信息。
3 產品分類
在新加坡,體外診斷產品(IVD)視為醫療器械產品(MD)的子集。新加坡醫療器械的分類規則以全球醫療器械協調工作組(GHTF)建議為基礎。
所有醫療器械在新加坡供應之前都需要向HSA註冊 ,但 A 類非無菌低風險醫療器械除外,它們免於產品註冊,或在HSA批准的特定條件下提供。
醫療器械的風險分類取決於產品的設計和預期用途。新加坡將醫療器械(包括IVD)根據風險由低至高分為A、B、C、D四類。A類風險最低,D類風險最高。
具體分類如下:
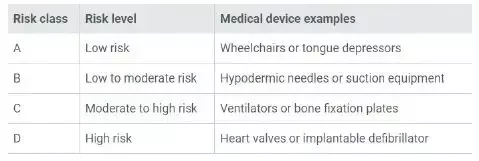
1 新加坡常規醫療器械分類
A 低風險
手術牽引器、壓舌板。
B低-中度風險
皮下注射針、吸入式設備
C 中-高度風險
肺呼吸機、骨固定板
D 高風險
心臟瓣膜、植入式初顫器
英文原文見下圖:
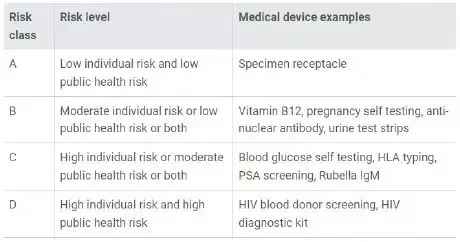
2 新加坡體外診斷醫療器械分類
A 低個人風險和低公共健康風險
試樣貯器
B 中等個人風險和低等公眾健康風險
維生素B12,妊娠自我檢測,抗核抗體,尿液試紙
C 高個人風險和中等公眾健康風險
血糖自我檢測,HLA分型,PSA篩查,風疹lgM
D 高個人風險和高公眾健康風險
愛滋病毒獻血者篩查,愛滋病毒診斷試劑盒
英文原文見下圖:
4 產品註冊
新加坡實行與國際接軌的醫療器械分類管理制度,即按安全風險將醫療器械分為A、B、C、D類共4個類別進行管理。
根據新加坡《健康產品法令》及《健康產品(醫療器械)條例》的規定,除了豁免產品,所有類別的醫療器械產品都必須經過HSA註冊方可在新加坡上市銷售。
新加坡當地沒有營業地點的境外製造商需指定一名符合要求的註冊登記人。註冊登記人必須在HSA註冊登記擁有相應的經銷商許可證(Dealer’s Licence),一系列的申請工作將由註冊登記人進行。
註冊人或申請人須通過HSA的醫療器械信息與通訊系統Medical Device Information and Communication System在線提交申請。凡是經過註冊的醫療器械,都列入新加坡醫療器械註冊清單(SMDR) 中,消費者可在線查詢所購買的醫療器械是否經過註冊。
A類醫療器械的註冊申請分為4步,即提交申請、篩選、評審、主管部門作出決定。其中,非無菌A類醫療器械可以免除註冊,但該類醫療器械仍需符合醫療器械安全與性能的基本要求,不得與相關法律法規相牴觸。無菌A類醫療器械(含體外診斷器械)仍需進行註冊。
BCD類產品的申請材料包括,參照東協通用提交資料模板(CSDT)準備的英文申請,相關證書、報告和標籤複印件。同時,還應提交良好的流通規範證書(GDPMDS)或醫療器械質量管理體系ISO 13485證書。如果已經獲得美國(美國食品和藥物管理局)、歐洲(歐盟公告機構)、澳大利亞(澳大利亞治療用品管理局)、日本(日本厚生勞動省)、加拿大(加拿大衛生部)上市批准,在提供相關證明文件後,可加快註冊甚至立即註冊。
此外,申請公司還需要指定一名主要聯繫人,負責與主管部門聯絡與申請相關的所有問題,包括按要求補充材料等。提交註冊文件,並且當局批准後,會列入SMDR(Singapore Medical Device Register)資料庫,申請人應遵守所有的註冊後條款。並對後續活動負責。

5 申請流程
在確定了醫療器械的評估路線和風險等級後,根據不同的類別分類,可以在官方查看詳細的相關指南,了解完成註冊所需的文件、費用和處理時間。
Class A
不需要進行註冊。在申請經銷商許可證時需要列明相應的豁免Class A類產品信息。
Class B
Full route
產品如果沒有被任何一個海外參考監管機構批准,則必須選擇該途徑,由HSA對產品進行全面評估。
Abridged route
產品目前已被至少一個海外參考監管機構批准,就可選擇該簡略的評估途徑註冊。
Immediate route
符合以下條件就有資格選擇該途徑進行申請,條件一:
1. 至少一個海外參考監管機構批准。
2. 在其中一個海外參考監管機構的管轄範圍內至少銷售了三年。
3.沒有因質量、性能或安全問題而被任何一個海外參考監管機構拒絕/撤回。
4.在過去3年或產品自在全球上市以來,全球範圍內沒有與使用該醫療器械有關的安全問題。
條件二:
1. 至少兩個海外參考監管機構批准。
2.沒有因質量、性能或安全問題而被任何海外參考監管機構拒絕/撤回。
3.在過去三年中,全球範圍內沒有與使用該醫療器械有關的安全問題。

Class C
Full route
如果沒有被任何一個海外參考監管機構批准,則必須選擇該途徑,由HSA對產品進行全面評估。
Abridged route
產品目前已被至少一個海外參考監管機構批准,就可選擇該簡略的評估途徑註冊。
Expedited route
快速評估途徑有兩種,產品只要符合其中一種快速評估途徑的要求即可提交申請。
加快評估途徑一
1. 至少被一個海外參考監管機構批准。
2. 在被批准的海外參考監管機構的管轄範圍內至少銷售了三年時間。
3. 在過去三年中,全球範圍內沒有與該醫療設備的使用相關的安全問題。
加快評估途徑二
已獲得至少兩個海外參考監管機構的批准,就可通過該途徑進行註冊。

Immediate route
該途徑僅適用於獨立的醫療移動應用,需滿足以下的要求:
1. 它僅僅是一個獨立的醫療移動應用。
2. 至少獲得一個海外參考監管機構的批准:
3. 沒有因質量、性能或安全問題而被任何海外參考監管機構拒絕/撤回。
4. 在過去三年中,全球範圍內沒有與使用該醫療設備有關的安全問題

Class D
Full route
產品如果沒有被任何一個海外參考監管機構批准,則必須選擇該途徑,由HSA對產品進行全面評估。
Abridged route
產品目前已被至少一個海外參考監管機構批准,就可選擇該簡略的評估途徑註冊。
Expedited route
醫療器械產品已獲得至少兩個海外參考監管機構的批准,則可選擇該途徑進行申請。
但對以下兩類IVD產品的註冊,該途徑不適用 : HIV檢測(篩查和診斷)

怎麼樣!是不是很詳細呢~關於新加坡衛生科學局Health Sciences Authority的醫療器械管理,你都了解了嗎?







