早前,新加坡跨部門抗疫工作小組在記者會回答提問時表示:將於8月第一周完成所有客工宿舍的檢測。
8月7日,是這個承諾期限的最後一天。
然而在8月5日,新加坡的單日新增確診人數達到908例,消息一出,整個坡島都震驚了。對此,政府給出的解釋是,大規模的客工檢測也可能會導致接下來幾天的單日新增病例都會處於比較高的狀態。

有網友表示:「這是快要到日子了,開始沖業績了嗎?」
「沖業績」的描述只是大家在面對這種令人哭笑不得的狀況時不得已的樂觀。
隨著客工宿舍的疫情檢測接近尾聲,新加坡政府表示:到8月底,預計90%的客工會復工。
即便政府一再強調,到了八月中旬,新加坡的單日新增就會開始逐步減少,但是疫情再次反撲的危險依然沒有遠離新加坡,遠離我們。
早前,世界衛生組織曾表示:在成功研發出安全有效的疫苗前,新冠病毒仍對全球構成重大威脅。
或許只有等到疫苗研製成功並正式投入使用的那天,我們才能稍稍放心下來。
那麼問題來了:身在新加坡的我們,離打上新冠疫苗,到底還有多遠?
01. 新冠疫苗「太難了」
這裡要告訴大家一個悲觀的現實:疫苗研發一向是相當慢的。
伊波拉病毒於 1976 年發現,直到 2017 年,第一個疫苗才研發成功,花了三十多年。

第一個愛滋病疫苗早在 1987 年就開始進行臨床試驗,但三十多年過去了,全世界有數十個疫苗進入臨床,至今仍未有一個成功。
據統計,一支疫苗的平均研發周期是 8 到 20 年,超過了大多數藥物的平均水平,同時耗資數億至數十億美金。
所以,疫苗的研發一向是「三耗」:耗時、耗錢、耗力。
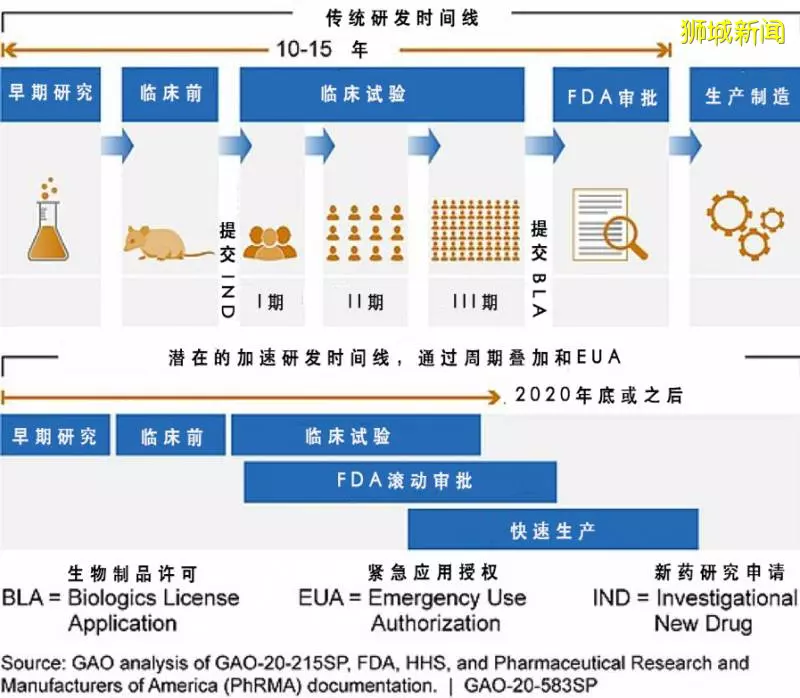
不幸中的萬幸,新冠疫苗是人類有史以來,在研發環節投入最密集、團隊最多、推進速度最史無前例的疫苗。
下圖中是國際組織提倡的、緊急疫苗研發和交付可能採用的流程,由於重疊進行臨床試驗、審批和生產,新冠疫苗研發的流程將大大加速,最樂觀可以在 2020 年底推出。
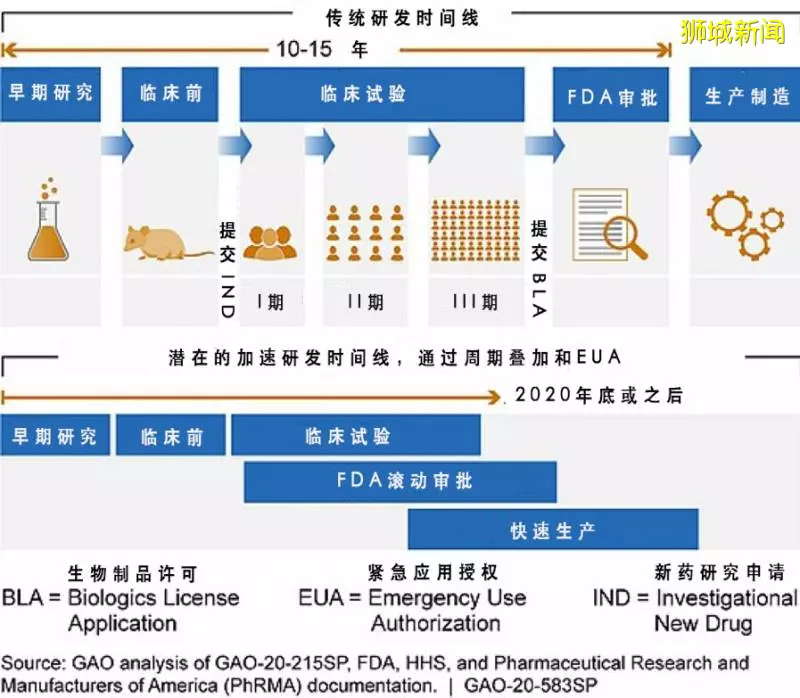
樂觀的聲音有很多。連比爾·蓋茨都說,預期的理想疫苗在 9 個月之內就能出現。
然而,也只是研製出來。
疫苗從研製成功到投入使用,還有很長的一段路要走。可以說,更加令人煎熬的,是對疫苗有效性、安全性漫長而反覆的驗證過程。
疫苗的臨床試驗和藥品一樣,共分四期。每種疫苗都需要經過四期臨床試驗,包括上市前的Ⅰ、Ⅱ、Ⅲ期,以及上市後的第Ⅳ期。
I 期的受試者人數一般不多,主要關注安全性,兼顧有效性。II 期臨床才是主要關注有效性的,之後還要通過 III 期臨床的大規模長期觀察。
有史以來,人類疫苗研發的總成功率大概為 7%,進入臨床試驗階段的疫苗最終的成功率也僅有 17%。
按照以往經驗,新冠肺炎目前研發中的疫苗雖然在理論上全都可行,但最終可能都會被一輪輪篩選淘汰,能留下幾個已是萬幸。
要知道,許多失敗的疫苗不是敗在 I 期、II 期臨床試驗,而是敗在參與人數更多的 III 期臨床試驗中。
而且,臨床試驗的時間是很難被大量壓縮的。篩選合適的病人入組需要時間,觀察病人對疫苗的免疫反應也需要時間。疫苗的安全、穩定和有效性需要格外慎重,一茬一茬地測試,反覆調試疫苗本身的要素、劑量、接種方式。
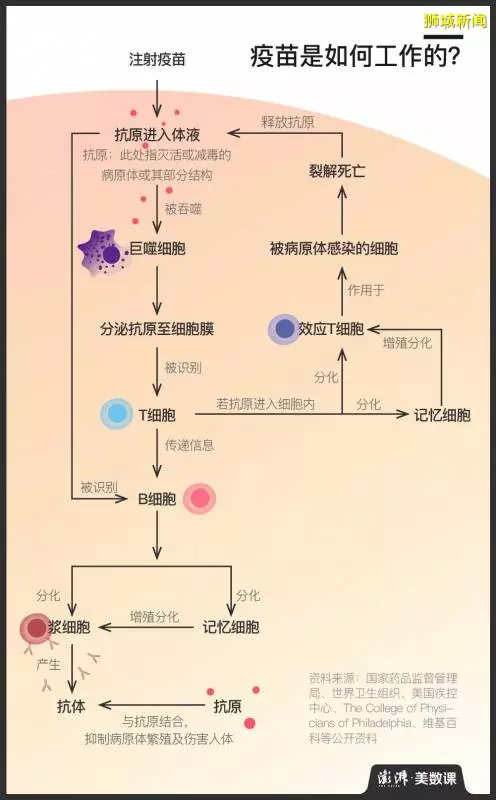
之所以要耗時如此之久,是由疫苗的運作原理決定的。
簡單地說,疫苗是通過將滅活或減毒的病原體或其部分結構注入人或動物體內,喚醒免疫細胞辨認、記憶抗原並生成相應的抗體,來使人或動物收穫對某種疾病的免疫力的。其效用依賴於被注入機體後所誘發的免疫應答,因而研發及臨床試驗的各個環節都充滿了未知。而如果想要打造一款在安全性、免疫反應強度、免疫持續期、時間及經濟成本等方面均表現出色的疫苗,耗時長更是必然的。
一支疫苗,從研發到臨床試驗,就要一路披荊斬棘,翻山越嶺。再算上之後的疫苗生產與大規模接種,更是難上加難。
根據 2017 年美國《疫苗》期刊的一項研究,新建一家單價疫苗製造廠的投入是 5000 萬到 5 億美元,多價疫苗廠更是高達 7 億美元。而這還不算僱傭員工的費用。
面對全球需求,疫苗成功研製出來後還將面臨加大生產規模、保證運輸、確保公平等一系列問題。
難,實在是難。
02. 全球疫苗研發生產進度條
為應對疫情,全球各國都在密切關注新冠疫苗研發,並且進行相關布局。
根據世界衛生組織公布的新冠肺炎候選疫苗概況,截至7月24日,全球共有166支新冠病毒候選疫苗,其中141支處於臨床前研究階段,25支已進入臨床試驗階段,並不斷地有最新研究進展公布。
全球公認可行的幾大新冠肺炎疫苗研發路線如下圖所示,全球數十個團隊的 166 種候選疫苗產品,都是從這些套路選一個,然後沿著自己選的路走下去。

最後到底哪條路能夠走通,沒有人知道。但是幾個有代表性的國家的疫苗研發生產進度條拉到了哪裡,我們倒是可以一起來看看:
——美國
7月最後一周,強生在研疫苗Ad26.COV2.S在比利時和美國先後啟動了人體試驗。
7月30日,強生公司宣布,其開發的主打新冠病毒疫苗在臨床前研究中取得積極結果。根據醫學雜誌《自然》刊發的研究結果,強生為一批獼猴注射其研發的候選疫苗六周後,將猴子暴露在病原體之下,除一隻顯示少量病毒外,所有獼猴都對病毒擁有免疫。
強生首席科學官斯托費樂思在聲明中表示,數據「顯示我們的SARS-CoV-2候選疫苗引起了強烈的抗體反應,單一劑量便可提供保護。」他說:
「這一結果在我們推進疫苗研發、加大生產之際,給我們帶來信心。」
8月6日,強生宣布,其楊森製藥公司已與美國政府達成協議,將在美國國內大規模生產和提供1億劑楊森的新冠疫苗,經美國食品和藥物管理局(FDA)批准或緊急使用授權後,可在美國使用。
——法國
據參考消息稱,法國企業賽諾菲在當地時間7月31日的一份公告中宣布,其與GSK聯合研發的疫苗被美國「曲速行動」計劃選中。該項計劃通過與各大藥企簽約,力圖讓美國人儘快拿到新冠疫苗。具體來說,賽諾菲和GSK將拿到21億美元,初期向美國提供1億劑新冠疫苗。

賽諾菲解釋說,這一合作「會給研發活動帶來更多資金支持,也能幫助賽諾菲和GSK提高在美國的疫苗生產能力」。該企業還表示,另一個選項是在首批供貨後再向美國提供5億劑疫苗。
兩家藥企使用的技術是,依靠賽諾菲製造流感疫苗的重組蛋白質技術,加上GSK研發的預防傳染病佐劑。前者表示會在9月開始進行Ⅰ期和Ⅱ期臨床試驗,年底進行Ⅲ期試驗,希望在2021年上半年疫苗能夠獲批上市。
——俄羅斯
俄羅斯研製的一種新冠疫苗已於6月啟動Ⅰ期臨床試驗。有一批受試者7月20日出院,他們均感覺良好。
俄羅斯加馬列亞流行病與微生物學國家研究中心主任金茨堡早前表示,如果Ⅱ期、Ⅲ期臨床試驗順利,首批俄制新冠疫苗有望於今年秋季投產。

早前,《瑞典日報》指出,俄羅斯政府將搶先一步,計劃8月就批准疫苗。
8月1日,據俄羅斯新聞社(RIA)報道,俄羅斯衛生部長穆拉什科表示,俄羅斯大規模的新冠疫苗接種工作將在10月啟動。他沒有提供有關疫苗的具體詳情,只表示醫生和教師將率先接受疫苗接種。
這樣一來,俄羅斯將在Ⅲ期臨床試驗結束前就開始大規模接種,而在Ⅲ期通常能發現新疫苗的主要副作用。
此外,據美國臨床試驗信息網站的數據,目前俄羅斯專家共在80名患者身上測試過該疫苗,瑞典卡羅琳醫學院生物醫學分析教授馬蒂·塞爾貝里認為,參與測試的人數太少。
「在80多名患者身上試驗之後就批准疫苗——真的不要這樣做。要想搞清楚疫苗是否奏效,需要給數千人接種。只有這樣才能獲得關於疫苗效果和副作用的正確概念。」
這一消息曝出後,世界衛生組織也向俄羅斯建議,對任何藥物都要經過精細的試驗,並遵守一切安全使用規定。
——中國
目前,中國有包括國藥集團中國生物、軍事科學院軍事醫學研究院在內的多個團隊的新冠疫苗進入臨床試驗階段,成為全球研發新冠病毒疫苗成效最為顯著的國家。
國藥集團中國生物承擔研發的滅活疫苗目前已經進入Ⅲ期臨床試驗階段,並已具備大規模量產的能力,各項進度均處於全球領先地位。
國藥集團中國生物技術股份有限公司董事長在接受記者專訪時表示,樂觀估計,國產新冠病毒滅活疫苗最快或於今年底或明年初上市。

近日,國藥集團中國生物北京生物製品研究所新冠滅活疫苗生產車間通過國家相關部門組織的生物安全聯合檢查,具備使用條件。此前,該生產設施已取得新冠疫苗生產許可證。
康希諾生物的重組新冠肺炎疫苗也於2020年6月25日獲得中央軍委後勤保障部衛生局辦法的軍隊特需藥品批件,有效期為一年。這意味著康希諾生物重組疫苗可以在軍隊內部使用,之前揭盲的Ⅱ期臨床試驗數據證實其具有良好的安全性和較高的體液免疫和細胞免疫應答水平。