基礎科普
醫療器械是指直接或者間接用於人體的儀器、設備、器具、體外診斷試劑及校準物、材料以及其他類似或者相關的物品,包括所需要的計算機軟體。
效用主要通過物理等方式獲得,不是通過藥理學、免疫學或者代謝的方式獲得,或者雖然有這些方式參與但是只起輔助作用。
目的是疾病的診斷、預防、監護、治療或者緩解;損傷的診斷、監護、治療、緩解或者功能補償;生理結構或者生理過程的檢驗、替代、調節或者支持;生命的支持或者維持;妊娠控制;通過對來自人體的樣本進行檢查,為醫療或者診斷目的提供信息。
注 冊
一.概覽 1.評估路徑(每個設備都通過特定的評估路徑完成註冊,具體路逕取決於:)
(1)醫療設備的風險等級(A類醫療器械免予產品註冊)
(2)醫療設備在營銷期內無安全隱患的持續時長
(3)已獲管理機構事批准的設備數量
2.優先審查計劃-更快完成註冊、進入市場

二.定性
1.(完成問卷)—設備是醫療器械嗎
(1)產品是否服務於人類?
(2)產品是否能通過體外診斷(如:妊娠檢測試劑盒)提供醫療診斷信息?
2.問卷結果
(1)產品是醫療器械,確認風險等級
(2)產品不是醫療器械,受新加坡其他相關機構監管
三.確認醫療器械的風險等級(可通過問卷確定等級)
1.通用醫療器械 風險等級 風險程度 舉例
A 低風險 輪椅或壓舌板
B 低至中度風險 皮下注射針頭或抽吸設備
C 中度風險至高風險 呼吸機
D 高風險 植入式除顫器
2.體外診斷醫療器械 風險等級 風險程度 舉例
A 低個人風險和低公共衛生風險 樣本容器
B 中度個人風險或低公共衛生風險,或兩者兼具 妊娠自檢,尿檢試紙
C 高度個人風險或中度公共衛生風險,或兩者兼具 血糖自檢,白血球抗原分型
D 高度個人風險和高度公共衛生風險 HIV病毒診斷試劑盒 四.註冊及發牌
1.根據自身情況(如進口商、製造商、供應商)以及設備的使用目的等,通過問卷,查閱註冊及發牌條件;
2.確定醫療器械的評估路線。B類、C類、D類醫療器械的評估路線均可分為全面評估、簡化評估、加速註冊、即時註冊。各評估路線適用條件各有不同,以B類醫療器械不同評估路線適用的條件為例: 評估路線分類 全面 簡化 加速B類註冊(EBR) 即時B類註冊(IBR) 適用條件 產品尚未獲得HSA任何參考監管機構的批准 產品至少獲得1個HSA參考監管機構的批准 細分為EBR-1和EBR-2兩種評估路徑。 其中EBR-1適用於:
•產品至少獲得1個HSA獨立參考監管機構的批准;
•在上述獨立參考監管機構的管轄下,上市時間≥3年;
•無全球安全問題 EBR–2適用條件:
•產品至少獲得2個HSA獨立參考監管機構的批准;
•產品至少獲得2個HSA獨立參考監管機構的批准;
•在上述2個獨立參考監管機構的管轄下,上市時間≥3年;
•無全球安全問題
•之前未被任何獨立參考監管機構或HSA拒絕/召回。
3.明確完成註冊所需的文件、註冊費用和註冊時間;同樣以B類醫療器械不同評估路線適用的條件為例:
文件要求 全面 簡化 加速B類註冊(EBR-1 and EBR-2) 即時B類註冊(IBR)
1 授權書 √ √ √ √
2 配置列表 √ √ √ √
3 參考機構的批准證明 √ √ √
4 在參考監管機構管轄下的銷售歷史證明,例如注有日期的發票,銷售證明或營銷歷史聲明 √ 僅在EBR-1評估時需要 √
5 無全球安全問題的聲明 √
6 經營綜合報告 √ √ √ √
7 基本原則清單和符合性聲明 √ √ √
8 設備介紹 √ √ √ √
9 設計驗證和驗證文件,包括:
•臨床前研究,例如物理測試數據,生物相容性研究,動物研究和軟體驗證和驗證研究
•計量要求 •滅菌驗證(如適用)
•保質期研究和預計使用壽命 √ 詳細報告 √ 概要 √ 概要 √ 僅無菌設備需要滅菌驗證文件 10 臨床證據 如適用 11 擬用的設備標籤 √ √ √ √ 12 風險分析 √ 如適用 13 製造商信息(工廠名稱和地址) √ √ √ √ 14 質量管理體系(QMS)證明 - ISO 13485質量管理體系認證證書,符合美國FDA質量體系規定或日本MHLW條例169的認證聲明。
15 製造流程-流程圖 風險等級
註冊所需時間(工作日)
全面 簡化 加速B類註冊(EBR-1 and EBR-2) 即時B類注(IBR) B類醫療器械 1 6 0 1 0 0 60 提交後立即註冊 風險等級 申請費用 (單位:新元,S$)
評估費用(單位:新元,S$)
全面 簡化 加速B類註冊(EBR-1 and EBR-2)
即時B類註冊(IBR) B類醫療器械 500 3,500 1,800 900 900 五.優先審查計劃-更快完成註冊、進入市場
1.適用對象:進行全面評估的B類、C類、D類醫療器械
2.優先審查路線
(1)路線1—適用於五個重點醫療領域:癌症、糖尿病、眼科疾病、心血管疾病、傳染病;為未滿足的臨床需要而設計的醫療器械;
(2)路線2:不符合路線1兩條準則的其他醫療器械。
六.特殊通道(SAR):特定情況下,HSA可通過特殊通道批准進口和供應未註冊的醫療器械。
對 比 中 國 中國與新加坡在醫療器械的分類方面存在不同,與新加坡分為四類不同,中國分為三類「第一類是風險程度低,實行常規管理可以保證其安全、有效的醫療器械。第二類是具有中度風險,需要嚴格控制管理以保證其安全、有效的醫療器械。第三類是具有較高風險,需要採取特別措施嚴格控制管理以保證其安全、有效的醫療器械」(《醫療器械監督管理條例》)。醫療器械的分類規則和分類目錄由國務院食品藥品監督管理部門負責制定,並根據醫療器械生產、經營、使用情況,及時對醫療器械的風險變化進行分析、評價,對分類目錄進行調整。
中國的法律規定中不存在「仿製醫療器械」的說法。
第一類醫療器械實行備案管理,第二類、第三類醫療器械產品實行註冊管理;第一類醫療器械不需要進行臨床評價;第二類醫療器械產品原則上不需要進行臨床評價;第三類醫療器械產品註冊,應當進行臨床評價,其中,用於支持或者維持生命或者臨床使用具有高風險的第三類醫療器械,原則上需要開展臨床試驗。
境外創新企業(未在境內外上市的企業)可不遞交境外上市證明材料。
《醫療器械監督管理條例》第九條: 第一類醫療器械產品備案和申請第二類、第三類醫療器械產品註冊,應當提交下列資料:
(一)產品風險分析資料
(二)產品技術要求
(三)產品檢驗報告
(四)產品說明書及標籤樣稿
(五)與產品研製、生產有關的質量管理體系文件
(六)證明產品安全、有效所需的其他資料 產品檢驗報告可以是醫療器械註冊申請人或者備案人的自檢報告或者委託有資質的醫療器械檢驗機構出具的檢驗報告
申請第二類、第三類醫療器械產品註冊,需要臨床評價的,還應當按照規定提交醫療器械臨床評價資料
醫療器械註冊申請人、備案人應當確保提交資料的真實、完整和可追溯 醫療器械註冊證有效期為5年;附條件批准註冊的,由國務院藥品監督管理部門在醫療器械註冊證中明確有效期。有效期屆滿需要延續註冊的,應當在有效期屆滿6個月前向原註冊部門提出延續註冊的申請。」
第十一條:申請第二類和第三類醫療器械產品註冊,註冊申請人應當向國務院藥品監督管理部門提交註冊申請資料。
向我國境內出口第二類、第三類醫療器械的境外註冊申請人,應當由其在我國境內設立的代表機構或者指定我國境內的企業法人作為代理人,向國務院藥品監督管理部門提交註冊申請資料和註冊申請人所在國(地區)主管部門准許該醫療器械上市銷售的證明文件。未在境內外上市的創新醫療器械,可不提交註冊申請人所在國(地區)主管部門准許該醫療器械上市銷售的證明文件。
第十七條 第一類醫療器械產品備案,不需要進行臨床試驗。申請第二類、第三類醫療器械產品註冊,應當進行臨床試驗;但是,有下列情形之一的,可以免於進行臨床試驗:
(一)工作機理明確、設計定型,生產工藝成熟,已上市的同品種醫療器械臨床應用多年且無嚴重不良事件記錄,不改變常規用途的;
(二)通過非臨床評價能夠證明該醫療器械安全、有效的;
(三)通過對同品種醫療器械臨床試驗或者臨床使用獲得的數據進行分析評價,能夠證明該醫療器械安全、有效的。免於進行臨床試驗的醫療器械目錄由國務院食品藥品監督管理部門制定、調整並公布。
第十九條 第三類醫療器械進行臨床試驗對人體具有較高風險的,應當經國務院食品藥品監督管理部門批准。臨床試驗對人體具有較高風險的第三類醫療器械目錄由國務院食品藥品監督管理部門制定、調整並公布。
國務院食品藥品監督管理部門審批臨床試驗,應當對擬承擔醫療器械臨床試驗的機構的設備、專業人員等條件,該醫療器械的風險程度,臨床試驗實施方案,臨床受益與風險對比分析報告等進行綜合分析。准予開展臨床試驗的,應當通報臨床試驗提出者以及臨床試驗機構所在地省、自治區、直轄市人民政府食品藥品監督管理部門和衛生計生主管部門。
監 管
1.在新加坡,對藥物,生物製品和醫療器械享有管轄權的監管機構。
新加坡衛生科學局(HSA)。它是根據《衛生科學授權法》於2001年4月1日成立的衛生部法定委員會。
2.監管範圍
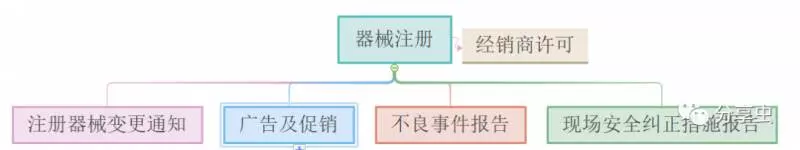
·必須先註冊才能供應該設備,註冊要求將根據設備的風險分類和評估途徑而有所不同。
·所有醫療設備經銷商都必須先申請經銷商許可,才能在新加坡進口,製造和供應設備。HSA會先評估是否符合《良好銷售規範》的要求,再授予許可。
·更改醫療設備必須事先通知HSA。包括技術更改、審查更改、管理更改、通知更改以及「現場安全糾正措施」造成的更改。
·如果設備對用戶健康構成風險,則必須通知HSA,採取補救措施,並告知用戶、醫療人員以及公眾。
小 疑 問 1.患者的藥物和設備如何支付?
第一層:新加坡的國家醫療體系融資來源
Ø 政府直接補貼:最高可覆蓋公立醫院急症住院費的80%
Ø 強制性個人醫療儲蓄帳戶計劃Medisave,出自員工工資和僱主(類比國內的五險一金?)
Ø 基礎低成本醫療保險計劃MediShield Life,主要針對高額的醫療帳單和門診費用,如透析化療等
Ø 政府資助醫療基金MediFund
Ø 其他:社區衛生援助計劃、老年人臨時殘疾援助計劃(此兩項主要針對殘疾人和老年人)藥物援助基金(公共部門醫療機構為某些藥物提供補貼)
第二層:私營部門(私人保險公司等):根據保單為藥品和醫療器械產生的費用提供補償 兩者在不同領域所占比例: 初級保健部門:私營部門約占市場的80%。
急診部門:公共部門提約占80%。
降級保健部門:自願性福利組織占大多數市場,大部分由政府資助提供服務。
2.誰來分配藥物和設備?獲得什麼補償(報銷)?
藥物分為: POMs處方藥——由醫生或者牙醫提供,或者在藥店憑醫生或牙醫開具的處方購買 P-medicines純藥房藥品——不需要處方,在藥店藥劑師的指導下購買 GSL通用銷售清單藥品——任何零售商處均可購買
醫療設備: 僅用於專業用途——醫療設備許可批發商/有資格證的醫生或牙醫 僅供受過培訓的用戶——受到過製造商認為有必要的關於安全有效使用該設備的培訓的人員 政府為某些藥物提供補貼(見第一條內容)























